INTRODUCCIÓN
La estadística estadounidense más reciente señala que, en este país, el cáncer
de mama es el tumor maligno más frecuente (y la segunda causa de muerte por
tumor maligno, después del cáncer de pulmón) en la mujer, de manera que -globalmente-
una de cada ocho mujeres desarrollará un cáncer de mama a lo largo de su vida
(1). El carcinoma ductal infiltrante (sin
más especificaciones) (CDI) representa aproximadamente el 75 % de los carcinomas
de la mama (2). En ausencia de metástasis
distantes, el pronóstico de las pacientes que presentan un CDI de mama está
determinado por diversos factores clínico-patológicos, y uno de los más importantes
es el estado de los ganglios linfáticos axilares (metástasis o ausencia de metástasis)
cuando se diagnostica el tumor. No obstante, a pesar de la ausencia de metástasis
ganglionares y sistémicas (estadios I y IIA-B con T2 o T3 en el estadiaje TNM
de 1997 de la AJCC [3]), aproximadamente
el 30 % de los CDI presenta recidiva y muchas de estas pacientes fallecen finalmente
debido a la enfermedad. La administración universal de quimioterapia adjuvante
a las pacientes con CDI y sin metástasis ganglionares está limitada por el escaso
número de respuestas, por los efectos adversos y por el coste del propio tratamiento.
Los parámetros que se han considerado para valorar el riesgo de recidiva y -por
tanto- la indicación de quimioterapia adyuvante en los casos de CDI sin metástasis
ganglionares iniciales son fundamentalmente el tamaño del tumor, el grado histológico,
el estado de los receptores hormonales, el oncogen c-erbB-2, el gen supresor
tumoral p53, la ploidía y el porcentaje de células en fase S (3).
La determinación de la poidía y de la fase S en el cáncer de mama representa
en este momento la principal aplicación asistencial de la citometría de flujo
en lo que se refiere a los tumores sólidos (4).
En nuestro estudio se han obtenido la ploidía, el índice de ADN y la fase S
mediante citometría de flujo en una serie de 94 casos consecutivos de CDI de
mama femenina, y se ha comprobado la relación de estos parámetros con las variables
edad de la paciente, tamaño del tumor, grado histológico del tumor y metástasis
ganglionares. El objetivo principal en esta serie ha sido estudiar el grado
de correlación entre ploidía y fase S del CDI, y presencia o ausencia de metástasis
en ganglios linfáticos axilares cuando se interviene quirúrgicamente el tumor.
PACIENTES Y MÉTODOS
Una serie de 94 casos consecutivos de CDI de mama femenina procesados de manera
rutinaria para estudio anatomopatológico, con fijación en formol e inclusión
en parafina. Estudio histológico covencional con consideración y determinación
-entre otros parámetros- de la edad de la paciente, el tamaño macroscópico del
tumor, el grado histológico de malignidad (sistema de Bloom-Richardson, modificación
de Elston y Ellis [5]) (Figuras
1, 2 y 3)
y la presencia o ausencia de metástasis en ganglios linfáticos axilares. Preparación
de la suspensión celular mediante la técnica de Hedley modificada y tinción
con yoduro de propidio (6). Adquisición
y lectura de las suspensiones con un citómetro FACScanTM (Becton-Dickinson)
y análisis con ModFit LT v2.0TM (Verity Software House) para Windows 95TM. Cualidad
de valorable de la ploidía, la fase S o ambas (Figuras
4, 5 y 6)
en cada caso según criterios consensuados a nivel nacional (7)
e internacional (8) [básicamente, número
de células analizadas (> 10.000), porcentaje de agregados y debris (< 20,00),
bondad de ajuste de los datos al modelo matemático aplicado (< 5,000) y coeficiente
de variación (< 8,00)]. Para determinar la asociación entre las variables de
estudio se utilizó el coeficiente de correlación de Pearson (r) entre variables
cuantitativas. Con respecto a las variables categóricas, la asociación se determinó
mediante el test de chi-cuadrado; la distribución de medias entres estas variables
categóricas se cuantificó mediante el procedimiento de Kruskal-Wallis. Los valores
de p < 0,05 se consideraron estadísticamente significativos. El análisis estadístico
se efectuó con el programa EpiInfoTM
RESULTADOS.
La ploidía fue valorable en 85/94 (79,9 %) casos, mientras que la fase S lo
fue en 64/94 (56,4 %) casos (todos los casos con fase S valorable presentaban
además ploidía valorable). La disección ganglionar para confirmación o exclusión
de metástasis se realizó en 63/94 (59,2 %) casos.
- Las características descriptivas de la muestra completa (N = 94) relativas
a edad, tamaño del tumor, grado histológico y metástasis ganglionares, según
la ploidía, aparecen en las Tablas 1,
2 y 3.
- Las características descriptivas de la muestra con ploidía valorable (n=85)
relativas a los parámetros citométricos número de eventos, ajuste a modelo,
porcentaje de agregados y debris, coeficiente de variación e índice de ADN,
según la polidía, aparecen en las Tablas
4, 5 y 6.
- En el estudio inferencial, la aplicación del test de chi-cuadrado para
determinar la asociación entre variables categóricas, y del procedimiento
de Kruskall-Wallis para analizar la distribución de medias entre estas mismas
variables categóricas y cuantitativas, demostró -en la muestra de casos con
ploidía valorable (n=85)- la existencia de una relación estadísticamente significativa
entre
- Ploidía y porcentaje de células en fase S (p = 0,0069)
- Grado histológico e índice de ADN (p = 0,0246)
- Grado histológico y porcentaje de células S (p = 0084) con ausencia
de esta relación en las demás asociaciones posibles.
- La aplicación del coeficiente de correlación de Pearson entre variables
cuantitativas demostró significación estadística entre
- Edad e índice de ADN (r = 0,21701; p = 0,0460).
Finalmente, el test de chi-cuadrado entre variables categóricas demostró una
relación estadísticamente significativa entre
- Ploidía y grado histológico (p = 0,037).
DISCUSIÓN
En el cáncer de mama, la aneuploidía relativa al contenido de ADN de las células
tumorales se ha asociado a diferenciación tumoral escasa, elevada actividad
proliferativa y ausencia de receptores hormonales en las células neoplásicas,
mientras que los carcinomas de mama bien diferenciados suelen presentar receptores
hormonales, muestran un contenido normal de ADN y presentan una actividad proliferativa
baja. De hecho, la aneuploidía del ADN se ha correlacionado de manera repetida
con recidiva de la enfermedad y baja supervivencia, mientras que el contenido
normal de ADN (diploidía) representa una característica pronóstica favorable
(9). El análisis estadístico en nuestro
estudio demostró una relación significativa entre la ploidía y la fase S, tal
y como se ha observado en otras series de la literatura (9).
A diferencia de lo que se ha observado en muchas series de la literatura (10),
la mayor parte de nuestros casos de CDI de mama -57/85 (67 %)- fueron diploides,
lo que posiblemente está en relación con la consideración práctica -por parte
de ModFitTM- de diploidía en todos los tumores cuyo índice de ADN oscila entre
1,00 y 1,20. No obstante, la categorización de la ploidía según el grado histológico
demostró correlación estadísticamente significativa entre ambas variables, tal
y como se ha observado repetidamente en la literatura (9,10).
Las demás asociaciones estadísticamente significativas observadas en nuestra
serie -índice de ADN/edad, índice de ADN/grado histológico y fase S/grado histológico-
también han sido observadas en muchas de las series similares a la nuestra,
aunque no en todas (9,10).
Posiblemente, uno de los datos más relevantes de nuestro estudio es la ausencia
de relación estadísticamente significativa entre ploidía y presencia o ausencia
de metástasis en ganglios linfáticos axilares en la muestra con disección axilar
y ploidía valorable (63/94), resultado que corrobora lo observado en otras series
(9,10,11).
En conclusión, los resultados de nuestra serie y la revisión de la literatura
no demuestran que la citometría de flujo para cuantificación de ADN en el CDI
de mama femenina añada información independiente -respecto a los parámetros
histológicos convencionales- que pueda tener valor pronóstico o terapéutico
en esta enfermedad.
PALABRAS CLAVE
Carcinoma ductal infiltrante; mama; ADN; citometría de flujo.
BIBLIOGRAFÍA
- Landis SH, Taylor M, Bolden S, et al. Cancer
statistics, 1998. CA Cancer J Clin 1998; 48:6-29.
- Rosen PP. Invasive duct carcinoma and morphological
prognostic markers. En: Rosen's Breast pathology. Lippincott-Raven,
Philadelphia, 1997.
- Tavassoli FA. Pathology of the breast,
2nd edition. Appleton&Lange, Stamford, 1999.
- McCoy JP, Overton WR. A survey of Current
Practices in Clinical Flow Cytometry. Am J Clin Pathol 1996; 106:82-86.
- Elston CW, Ellis IO. Method for grading breast
cancer. J Clin Pathol 1993; 46:189-190.
- Hedley DW, Friedlander ML, Taylor IW, Rugg CA,
Musgrove EA. Method for analysis of cellular DNA content of paraffin-embedded
pathological material using flow cytometry. J Histochem Cytochem
1983; 31:1333-1335.
- Consensus review of the clinical utility of
DNA cytometry in carcinoma of the breast. Hedley DW, Clark GM, Cornelisse
CJ, Killander D, Kute T, Merkel D. Cytometry 14:482-485, 1993.
- Sampedro A, Salas A, García-Miralles T, Alonso-Guervós
M. Protocolo de estandarización del análisis de ADN por citometría
de flujo en tumores sólidos. Boletín informativo de la Sociedad
Ibérica de Citometría, noviembre de 1997.
- Riley RS. Clinical applications of DNA ploidy
and cell cycle analysis. En Riley RS, Mahin MJ, Ross W (eds.) Clinical
applications of flow cytometry. New York, Igaku-Shoin, 1993.
- Hedley DW. Breast cancer. En Bauer KD, Duque RE,
Shankey TW. Clinical flow cytometry: Principles and application.
Baltimore, Williams and Wilkins, 1993.
- Frierson HR Jr. Ploidy analysis and S-phase
fraction determination by flow cytometry of invasive adenocarcinomas of
the breast. Am J Surg Pathol 15:358-367, 1991.
FIGURAS
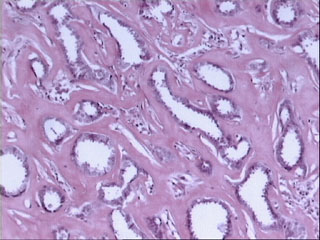
Figura 1. Imagen histológica correspondiente a un carcinoma
ductal infiltrante de mama con grado histológico I (Bloom-Richardson,
modificación de Elston y Ellis) con puntuaciones de 1, 2 y 1 (total,
4) en los items de arquitectura tubular, atipia citológica e índice
mitósico, respectivamente. (HE, X100.)
|
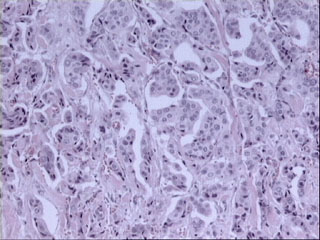
Figura 2. Imagen histológica correspondiente a un carcinoma
ductal infiltrante de mama con grado histológico II (Bloom-Richardson,
modificación de Elston y Ellis) con puntuaciones de 3, 2 y 1 (total,
6) en los items de arquitectura tubular, atipia citológica e índice
mitósico, respectivamente. (HE, X100.)
|
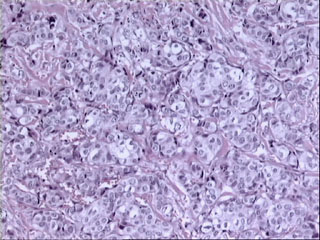
Figura 3. Imagen histológica correspondiente a un carcinoma
ductal infiltrante de mama con grado histológico III (Bloom-Richardson,
modificación de Elston y Ellis) con puntuaciones de 3, 3 y 2 (total,
8) en los items de arquitectura tubular, atipia citológica e índice
mitósico, respectivamente. (HE, X100.)
|
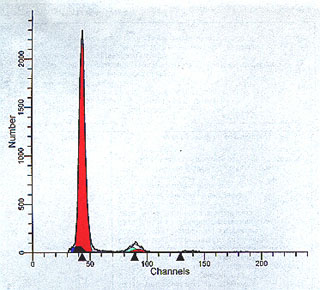
Figura 4. Histograma obtenido con ModFit LT v2.0TM (véase
el epígrafe Paciente y métodos). Población celular diploide (índice
de ADN, 1,00), con linealidad (G2/G1) 2,01, escasa cantidad de agregados
y debris (área azul sólida en la base de G1) y fase S baja.
|
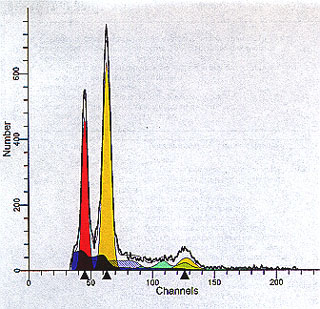
Figura 5. Histograma obtenido con ModFit LT v2.0TM (véase
el epígrafe Paciente y métodos). Población celular aneuploide (índice
de ADN, 1,34), con linealidad (G2/G1) de la población aneuploide 2,04,
cantidad aceptable de agregados y debris (área azul sólida en la base
de G1) y fase S de la población diploide (área con rayado azul a partir
de G1 diploide ) del 14,23 %.
|
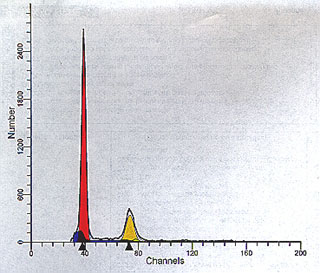
Figura 6. Histograma obtenido con ModFit LT v2.0TM (véase
el epígrafe Paciente y métodos). Población celular tetraploide (índice
de ADN, 2,01 [G1 aneuploide coincide casi exactamente con G2 diploide]),
con linealidad (G2/G1) de la población aneuploide 2,04, cantidad aceptable
de agregados y debris (área azul sólida en la base de G1) y fase S de
la población diploide realtivamente baja.
|
Tabla 1.- Ploidía en relación con la edad y con el tamaño
del tumor en la muestra completa (N=94)
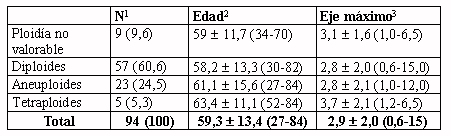
1Número y porcentaje
de casos.
2Edad media, desviación estándar
y rango de edades, en años.
3Eje máximo (tamaño) medio del tumor, desviación estándar
y rango de ejes máximos, en cm.
|
Tabla 2.- Ploidía en relación con el grado histológico de
Bloom y Richardson (modificación de Elston y Ellis) en la muestra de
casos con ploidía valorable (n=85).
1Número y porcentaje
de casos.
2Grado histológico I, II o III de Bloom y Richardson (modificación
de Elston y Ellis), número y porcentaje de casos.
|
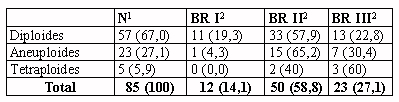
Tabla 3.- Ploidía en relación con la presencia de metástasis
ganglionares en la muestra de casos con disección ganglionar y ploidía
valorable (n=63).

1Número y porcentaje de casos.
2Pacientes con metástasis en ganglios linfáticos axilares,
número y porcentaje de casos.
|
Tabla 4.- Ploidía en relación con diversos parámetros citométricos
en la muestra de casos con ploidía valorable (n=85).
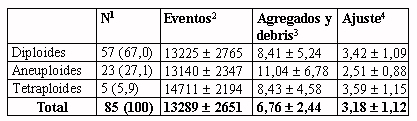
1Número y porcentaje
de casos.
2Eventos analizados, incluyendo agregados (dupletes, ...)
y debris, media y desviación estándar.
3Agregados y debris presentes en la muestra analizada, media
y desviación estándar.
4Bondad de ajuste del modelo a los datos observados según
el valor de chi-cuadrado reducido, media y desviación estándar.
|
Tabla 5.- Ploidía en relación con diversos parámetros citométricos
en la muestra de casos con ploidía valorable (n=85).
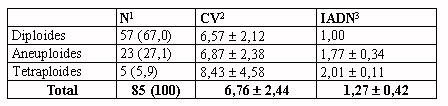
1Número y porcentaje
de casos.
2Porcentaje de coeficiente de variación del pico G1 de la
población diploide, media y desviación estándar.
3Índice de ADN o relación entre la cantidad de ADN de la
fase G1 de la población no diploide (en su caso) y la de la fase G1
de la población diploide, media y desviación estándar.
|
Tabla 6.- Ploidía en relación con el porcentaje
de células en fase S, en la muestra de casos con polidía y fase S valorables
(n=64).
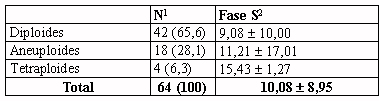
1Número y porcentaje de
casos.
2Porcentaje de células en fase S de la población diploide
en los casos diploides, y de la combinación de las poblaciones diploide
y no diploide en los casos aneuploides y tetraploides, media, desviación
estándar y rango.
|











