INTRODUCCIÓN
Se han considerado diversas causas de criptorquidia, incluyendo factores hormonales
y anomalías anatómicas. Se ha demostrado que un gran número de testículos no
descendidos tienen una lesión primaria y congénita de las células germinales
y probablemente de las células de Sertoli. Generalmente, el tipo de lesión observada
es variable y se relaciona directamente con la localización inguinal y escrotal
alta o intraabdominal del testículo criptorquídico. Sin embargo, la intensidad
de las lesiones del testículo criptorquídico dependen también mucho de un tratamiento
de descenso testicular quirúrgico retardado. Actualmente, se recomienda que
este descenso testicular quirúrgico del testículo criptorquídico sea realizado
en niños de dos o tres años de edad.
En la pubertad, las lesiones criptorquídicas progresan y ya en testículos
de pacientes adultos se pueden encontrar dos tipos de lesiones: i) tubos seminíferos
con un patrón de sólo células de Sertoli, y ii) un patrón mixto de esclerosis
y fibrosis intersticial de los tubos seminíferos. Generalmente, cada paciente
presenta uno de estos dos patrones, aunque en algunos casos, sobre todo en los
testículos localizados en el canal inguinal alto, existen extensas áreas de
fibrosis intersticial entremezcladas con otros tubos con un patrón de sólo Sertoli
(1).
Alteraciones en los microvasos testiculares han sido observados tanto en la
criptoquidia animal como en la del hombre, aunque estas lesiones no han sido
bien establecidas (1). En el presente
trabajo se realiza un estudio cuantitativo de la evaluación patológica de los
microvasos testiculares en la criptorquidia y se describen, en nuestro conocimiento
por primera vez, la actividad angiogénica y esteroidogénica de la hiperplasia
multinodular de células de Leydig en el testículo criptorquídico postpuberal.
Se comentan los criterios de diagnóstico diferencial con los tumores de células
de Leydig benignos y con otras lesiones proliferativas congénitas y adquiridas
de las células de Leydig.
MATERIAL Y METODOS
En el presente trabajo se realiza un estudio cuantitativo de la evaluación
patológica de los microvasos testiculares y de la secreción de testosterona
en 47 testículos criptorquídicos postpuberales y en 10 testículos adultos normales
(control), usando métodos inmunohistoquímicos para la detección del anticuerpo
anti-endotelial CD 34 (Dako) a una dilución 1: 200 y el anticuerpo anti-testoterona
(Biogenes) a una dilución 1: 400. Así mismo se ha usado un método de cuantificación
estereológica para valorar los microvasos en el testículo criptorquídico.
RESULTADOS Y DISCUSIÓN
La inmunoexpresión de testosterona en las células de Leydig aparece como un
marcaje granular en el citoplasma; aunque existe una variación en la intensidad
de inmunotinción de testosterona, como consecuencia de la diferente actividad
esteroidogénica de estas células, la mayoría de las células normales tienen
una moderada o intensa expresión de testosterona. De otra parte, la inmunoexpresión
del anticuerpo anti CD34 se localiza en le citoplasma de las células endoteliales,
lo que permite determinar muy bien el contorno de los microvasos, incluidos
aquellos de muy escaso diámetro, sin embargo, no se observa inmunoreacción en
otras células testiculares, incluyendo las células endoteliales de los vasos
linfáticos.
En los testículos criptorquídicos postpuberales, con esclerosis túbulo-intersticial,
las células de Leydig se agrupan en nódulos bien delimitados, pero no encapsulados,
no existiendo áreas de hiperplasia difusa de células de Leydig. Estos nódulos
son de diferente tamaño, se distribuyen difusamente por el parénquima testicular
y no forman masas confluentes con nódulos adyacentes (Fig.
1a y b). En el interior de los nódulos
existen células de Leydig de tipo adulto, con núcleo isomórfico y con abundante
citoplasma; pero entremezcladas con estas células normales, otras células de
Leydig muestran núcleos mas pleomórficos, en ocasiones binucleados, pero rara
vez presentan mitosis; su citoplasma es más escaso, de aspecto fibrilar y de
contorno menos nítido; por último, en algunos nódulos predominan las células
de Leydig multivacuoladas y en otros son más frecuentes las células de Leydig
poco diferenciadas, bien de tipo inmaduro-infantil o de tipo disgenético. La
inmunoexpresión de testosterona en las células de Leydig de estos nódulos es
muy variable, aunque menor que en las células de Leydig normales, existiendo
nódulos con una evidente actividad esteroidogénica y adyacentemente a ellos,
nódulos con mínima o ausencia de inmunoexpresión de Testosterona (Figs.
1c-e).
En el testículo criptorquídico humano, usando el anticuerpo anti endotelial
CD 34 (Fig. 2), el volumen ocupado por
el conjunto de arteriolas y vénulas, así como los capilares peritubulares representa
la mitad del valor con respecto al testículo normal. Sin embargo, no se han
visto diferencias significativas entre el volumen de los capilares intersticiales
de la criptorquidia, con respecto a los capilares intersticiales del testículo
normal. No existe evidencia de un verdadero proceso de angiogénesis en el testículo
normal o en aquellos patrones de la criptorquidia con solo células de Sertoli.
En el interior de los nódulos de células de Leydig existen abundantes capilares
que se aprecian mejor con el anticuerpo anti endotelial CD 34 (Fig.
2). En algunos nódulos, la proliferación capilar está aumentada, apareciendo
un claro patrón angiomatoso. La mayoría de los capilares están bien formados,
tienen una luz visible y están revestidos por múltiples células endoteliales,
con evidente expresión de CD34 que se distribuye homogéneamente por todo el
citoplasma. Además, en el interior de los nódulos de células de Leydig, existen
vasos capilares de muy discreto diámetro -angiotubos-, delimitados por un endotelio
CD 34 discontinuo; así mismo, también se puede objetivar la proliferación de
células endoteliales aisladas, identificadas por su expresión de CD 34 (Fig.
2). Esta intensa proliferación angiomatosa de los nódulos de células de
Leydig de la criptorquidia podría exigir el diagnóstico diferencial con un angioma
capilar, pero éste tumor benigno es excepcional en el testículo y suele ser
un hallazgo casual en una pieza de orquiectomia de pacientes adultos con un
testículo bien desarrollado.
Sin embargo, la cuantificación de los microvasos con el anticuerpo endotelial
CD34 revela una redución del número de los capilares intersticiales y peritubulares
así como el número de arteriolas y vénulas del testículo criptorquídico del
hombre adulto con respecto al del hombre adulto normal. Esta deficiencia vascular
observada en el testículo criptorquídico humano puede ser el resultado de un
mecanismo doble: una lesión malformativa primaria, lo que determina cambios
disgenéticos de los tubos seminíferos, y una lesión secundaria como consecuencia
de un patrón de esclerosis testicular muy frecuente en el testículo criptorquídico
adulto. Es más, los capilares peritubulares y los capilares intertubulares presentes
en el intersticio del testículo criptorquídico pueden tener lesiones progresivas
como consecuencia del proceso fibrótico del parénquima testicular en la criptorquidia.
En definitiva, en estos casos, el flujo sanguíneo testicular en la critporquidia
del adulto estará notoriamente disminuido, desarrollándose una serie de lesiones
microvasculares, que al igual que ocurre con las lesiones de las células de
los tubos seminíferos y de las células de Leydig, son irreversibles en el testículo
criptorquídico del hombre adulto.
La formación de nódulos de células de Leydig con actividad angiogénica y secretora
de testosterona en el testículo criptorquídico ocurre en los pacientes postpuberales
en los que existe atrofia del parénquima testicular y esclerosis túbulo-intersticial
completa. Este patrón no se asocia a hiperplasia difusa de células de Leydig,
la cual es muy infrecuente en el testículo criptorquídico, con excepción de
los casos con síndrome de insensibilidad a los andrógenos (2);
de otra parte hiperplasias difusas de células de Leydig son muy frecuentes en
el síndrome de Klinefelter, pero no se asocian con una angiogénesis evidente,
tampoco se ve especial neoformación microvascular en las hiperplasias difusas
congénitas del testículo del recién nacido.
La hiperplasia multinodular de células de Leydig descrita en la criptorquidia
postpuberal debe diferenciarse de los tumores de células de Leydig (3-5),
los cuales aparecen frecuentemente como nódulos únicos, bien delimitados y encapsulados,
en un testículo normalmente descendido. La mayoría de estos tumores benignos
de células de Leydig no son secretores de testosterona y no tienen un patrón
de angiogénesis como los nódulos de células de Leydig descritos en la presente
comunicación.
BIBLIOGRAFÍA
- Cobo P, Martínez-García F, Regadera J. Microvessels
in the human cryptorchid tetis. In: F. Martínez-García and J. Regadera
(eds.) Male Reproduction. A multidisciplinary overview. Churchill Comunications,
Madrid. 1998; p: 265-275.
- Regadera J, Martínez-García F, Paniagua R, Nistal
M. Androgen insensitivity syndrome. An immunohsitochemical, ultrastructural,
and morphometric study. Arch Pathol Lab Med 1999; 123: 225-234.
- Bercovici J-P, Nahoul K, Tater D, Charles J-F,
Scholler R. Hormonal profile of Leydig cell tumors with gynecomastia.
J Clin Endocrinol Metab 1984; 59: 625-630.
- Ekfors T, Martikainen P, Kuopio T, Malmi R. Ultrastructure
and immunohistochemistry of a fetal-type Leydig cell tumor. Ultrastruct
Pathol 1992, 16: 651-658.
- Wegner HEH, Herbst H, Andersen R, Dieckmann K-P.
Leydig cell tumor recurrence after enucleation. J Urol 1996;
156: 1443-1444.
FIGURAS
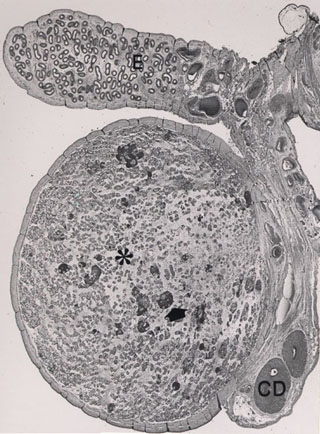
Fig 1a. Imagen panorámica de un testículo criptorquídico
extirpado en un hombre adulto. Se aprecian áreas de fibrosis intersticial
y varios nódulos de células Leydig. HE X 6.
|

Fig. 1b. Testículo criptorquídico completamente esclerosado
en el que existen numerosos nódulos de células de Leydig, bien delimitados,
pero no encapsulados. Nótese la ausencia de hiperplasia difusa de células
de Leydig y la diferente densidad de inmunotinción con testosterona.
Anti Testosterona-H X 10.
|
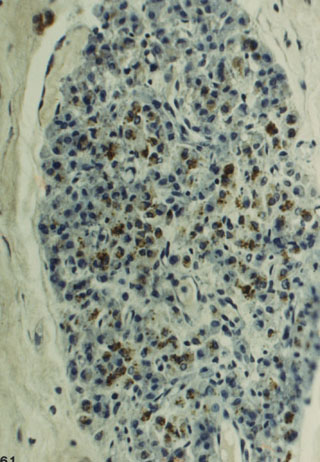
Fig. 1c. Nódulo de células de Leydig con moderada expresión
de testosterona. Anti Testosterona-H X 125.
|
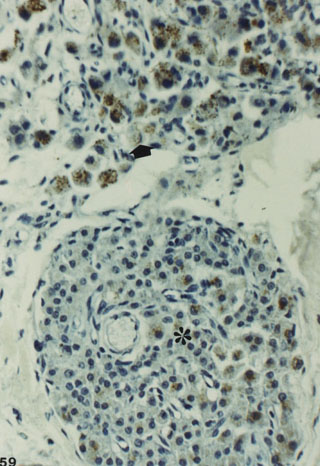
Fig. 1d. Distinta expresión de testosterona en dos nódulos
de células de Leydig contiguos. Anti Testosterona-H X 125.
|
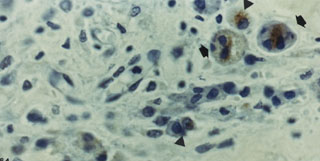
Fig. 1e. Nódulo de células de Leydig con abundantes alteraciones
nucleares, presencia de células binucleadas y mínima expresión de testosterona.
Destaca la proliferación de varios capilares. Anti Testosterona-H X
600.
|
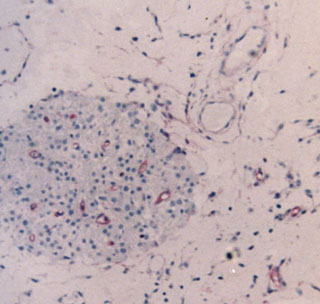
Fig. 2a. Nódulo de células de Leydig, bien delimitado, pero
no encapsulado, en el que existen varios capilares CD 34 positivos.
Anti CD34-H X125.
|
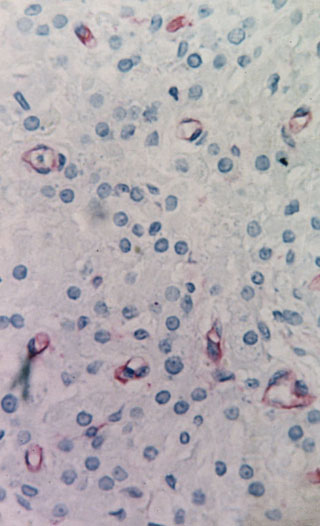
Fig. 2b. Detalle en el que se aprecia en centro de un nódulo
con numerosas células de Leydig de núcleo isomórfico, abundante citoplasma
y una proliferación de capilares bien desarrollados y angiotubos. Anti
CD34-H X 600.
|
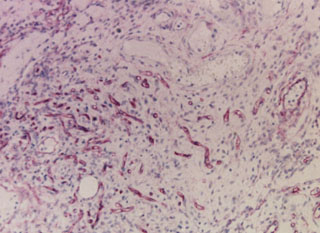
Fig. 2c. Nódulo de células de Leydig con intensa angiogénessis.
Anti CD34-H X 40.
|
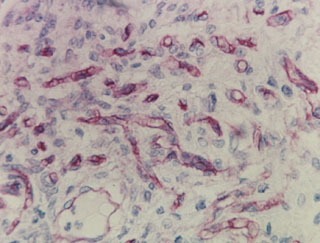
Fig. 2d. Se observan abundantes capilares y angiotubos neoformados,
con un patrón angiomatoso en el interior de un nódulo de células de
Leydig, algunas células endoteliales aisladas también expresan el antígeno
CD 34. Anti CD34-H X 600.
|








