RESUMEN
La piel es el órgano más extenso del cuerpo, y por lo tanto recibe la mayoría
de los antígenos ya sea en forma ambiental o tópica. Es por ello que ha desarrollado
un sistema inmune muy competente por medio del cual, contiene o neutraliza a
la mayoría de las noxas. El Eczema de Contacto es una entidad muy frecuente
en la práctica clínica dermatológica, con lesiones recidivantes debido al contacto
permanente con antígenos. Esto conduce a un estado de cronicidad con episodios
recurrentes que ocasionan prurito y malestar psico-físico. Esta entidad está
mediada por una multiplicidad de moléculas que amplifican la respuesta inflamatoria
e inmunológica, algunas de las cuales están producidas por queratinocitos, Células
de Langerhans y endoteliales, interaccionando todas ellas con la matriz extracelular.
Material y métodos
Se estudiaron 14 pacientes de ambos sexos, diagnosticados clínicamente como
portadores de Eczema por Contacto vinculados con su actividad laboral. Para
la detección del Antígeno contactante, se aplicaron parches cutáneos, efectuándose
la lectura en distintos tiempos y obteniéndose biopsias de las lesiones primarias
y las inducidas por parches. Los especímenes fueron estudiados por Microscopía
Optica, High Resolution Light Microscopy (HRLM) e Inmunohistoquímica.
Resultados
Los hallazgos histológicos mostraron un espectro variable en cuanto al tiempo
evolutivo: desde espongiosis y vesículas en los casos agudos, hasta cambios
crónicos representados por hiperqueratosis. Por medio de HRLM se visualizó con
una mayor resolución los diferentes componentes morfológicos de las estructuras
estudiadas, siendo relevantes las alteraciones en los es desmosomas, con aumento
del espacio intercelular y el infiltrado inflamatorio a predominio mononuclear.
A nivel Inmunohistoquímico, se pudo caracterizar el fenotipo de las células
inflamatorias y algunas moléculas de adhesión intervinientes en este proceso.
Conclusión
La interacción de diferentes disciplinas, fue fundamental para reconocer algunos
de los eventos fisiopatogénicos que se producen en esta entidad.
Palabra clave
ECZEMA - CLINICA - MO - HRLM -INMUNOHISTOQUIMICA
Bibliografía
- Abbas A, Lichman A, Pober J. Inmunología Celular y Molecular.
Mc Graw-Hill. Edit. Interamericana España. 1995; págs. 127-129, 248-260,
290-308.
- Grabbe S, Schwart T.: Immunoregulatory mechanisms involved in elicitation
of allergic contact hypersensitivity. Immunol Today. 1998; 19: 37-43.
- Frede S, Martín A, Cabalier M, Ortiz S, Serra M, Hliba E, Serra H. Estudio
Clínico-Patológico en Dermatitis por Contacto. Arch. Argent. Dermatol.
1999; 49: 113-119.
INTRODUCCIÓN
El Eczema por Contacto, también denominado Dermatitis por Contacto es una patología
frecuente en la consulta dermatológica. (1-2-3-4-5-6-7)
Es una entidad que ocasiona un fuerte impacto socio-económico, ya que en general
él o los antígenos que provocan el Eczema, constituyen habitualmente la herramienta
laboral de los pacientes. La piel, es un órgano muy extenso y envolvente, por
el cual penetra la mayoría de los antígenos ya sea en forma ambiental o tópica,
por lo cual ha desarrollado un Sistema Inmune muy competente (SIP). El mismo,
responde ante los diferentes antígenos que penetran, por medio de distintas
células y moléculas que no sólo tratan de contener al antígeno, sino que también
amplifican la respuesta inflamatoria.(1-8-9-10-11-12)
Debido a la gran cantidad de células y sustancias involucradas y a la diversidad
de antígenos, muchos de los eventos fisiopatogénicos del Eczema por Contacto
se desconocen.( 1-13)
Es por esto que, en la práctica médica esta entidad se resuelve en forma sintomática,
con medicación corticoidea y antripruriginosa, lo que no termina de resolver
el problema, ya que las lesiones recidivan, o se tornan crónicas por el permanente
contacto con el antígeno.
OBJETIVO GENERAL
El objetivo general de este trabajo, fue tratar de analizar y reconocer algunos
de los eventos fisiopatogénicos que se producen en la respuesta inflamatoria
en el Eczema por Contacto, por medio de diferentes técnicas.
OBJETIVOS ESPECIFICOS
- Realizar un estudio Clínico-epidemiológico constituído por un Universo de
pacientes portadores de Eczema de Contacto, excluidos o separados de otros
tipos de Eczema (Atópicos, Bacterianos, etc.)
- Analizar por medio de la Histopatología Convencional los cambios morfológicos
que se producen en esta entidad.
- Estudiar por medio de "High Resolution Light Microscopy" (HRLM) todos los
especímenes, ya que esta técnica debido a las características de la fijación,
inclusión en resinas epóxicas y al espesor de las secciones, permite una mayor
definición de las estructuras a estudiar.
- Realizar inmunomarcaciones con diferentes anticuerpos para tratar de dilucidar
qué antígenos de superficie están implicados en este proceso.
- Correlacionar los resultados Clínicos, Morfológicos e Inmunológicos de esta
entidad.
MATERIALES Y METODOS
El Universo estudiado correspondió a 14 pacientes, diagnosticados clínica y
epidemiológicamente como portadores de Eczema por Contacto.
Se realizó un Protocolo de Estudio de los pacientes, el cual consistió en aceptación
por escrito de su participación en el Proyecto de Estudio sobre Eczema por Contacto.
En el mismo se les comunicaba que se iba a aplicar parches cutáneos en la espalda
y posteriormente debían regresar para la lectura de los mismos a las 48 y a
las 96 hs. (Fig Nº1). Se les explicó que
se les realizarían tomas biópsicas de la lesión primaria y una toma de la reacción
más intensa de aquellas provocadas por la colocación de parches cutáneos.
Se realizaron estudios Clínicos y epidemiológicos de estos pacientes, observándose
las lesiones primarias y a posteriori las lesiones secundarias a la colocación
de los parches. Metodología para la utilización de los parches: Siguiendo el
Protocolo sugerido por el Grupo Internacional de Investigaciones en Dermatitis
de Contacto (ICDRG), se utilizó Batería Standard MARTI TOR (Barcelona España).
El Método de aplicación de parches fue Al Test (IMECO- Suecia). Los antígenos
contenidos en la Batería fueron: cloruro de cobalto, colofonio, dicromato de
potasio, sulfato de níquel, parabenos, resinas epoxi, sulfato de neomicina,
mezcla de thiurán, thiomersal, mercurio, aldehído cinámico, parafenilendiamina,
clorhidrato de benzalconio, alcoholes de lana, bálsamo de Perú, etilendiamina,
mezcla de PPD, breas de madera, mezcla carba, y mezcla de perfumes. La lectura
de los parches se realizó a las 48hs, a las 96 hs, y a los 7 días.
La valoración clínica de la reacción producida por la aplicación de los parches
se midió en cruces: eritema: +, eritema con formación de vesículas: ++, reacción
vesiculosa intensa y/o ampollosa: +++.
Para el estudio histopatológico se tomaron biopsias de las lesiones primarias
de mano y antebrazo y de la zona escapular donde se habían colocado los parches.
Este procedimiento se realizó con el fin de poder valorar las lesiones propias
del paciente y aquellas desafiadas por los antígenos. Las muestras obtenidas
de las lesiones secundarias correspondieron a aquellas en donde la reacción
se presentaba en forma más intensa. En ningún caso, la lesión provocada sobrepasó
los límites establecidos por el parche.
Cada espécimen fue dividido a su vez en dos fragmentos, los cuales fueron empleados
para Microscopía Optica e Inmunocitoquímica y para Microscopía de Alta Resolución
(MOAR) o High Resolution Light Microscopy (HRLM).
Para el estudio histopatológico los especímenes fueron fijados en formol al
10% durante 12 hs, incluidos en parafina y teñidos con Hematoxilina -Eosina.
Para el Estudio Inmunohistoquímico, los materiales fueron desparafinados con
xilol durante 15 min. Posteriormente se los hidrató en alcoholes de graduación
decreciente (100º, 96º, 75º) y agua bidestilada durante 10 min.
Para la recuperación antigénica fueron sumergidos en solución citratada (DAKO)
en baño María, durante 20 min. A posteriori, los especímenes fueron dejados
a temperatura ambiente y se lavaron en PBS (Fosfato Buffer Salino) a PH 7,6
durante 20 min. La peroxidasa endógena fue bloqueada con agua oxigenada (SIGMA)
al 3% durante 5 min. y seguidamente lavados exhaustivamente con PBS. Posteriormente
fueron incubados con PBS- Albúmina bovina (SIGMA) al 3% durante 20 min. para
bloquear sitios inespecíficos que pudiesen originar falsas marcaciones. Se los
incubó con los anticuerpos primarios correspondientes durante 30 min. en cámara
húmeda a temperatura ambiente, utilizándose diferentes diluciones.
Los anticuerpos monoclonales ratón anti-humano (CYTEL CORPORATION) utilizados
fueron: CD1a (cél. de Langerhans, cél. dendríticas y timocitos); CD3 (linfocitos
T); CD45RO (p180, linfocitos T de memoria); CD45RA (p220, leucocitos); CD 25
(Cad. a del receptor de IL-2, linfocitos T activados); CD15s (Sialil Lewis,
en granulocitos, cél. NK, linfocitos T y B activados y monocitos) y CD49d (Cadena
a4 de VLA-4, b1 integrina, que se expresa en leucocitos activados). Los anticuerpos
secundarios pertenecieron al Kit EXTRA-2 (SIGMA).
El revelado de los materiales se realizó con DAB (SIGMA FAST), Diaminobencidina
con metal resaltador en tabletas (que produce un color azul cobalto), deteniendo
la reacción con agua bidestilada y realizándose el contraste con verde de malaquita.
En algunos casos se utilizó el DAB sin metal que produce una marcación de color
marrón, obteniéndose el contraste con Hematoxilina. Los materiales que se utilizaron
para HRLM se fijaron en glutaraldehído-paraformaldehído a PH 7,2 enfriado durante
48 hs. El material fue lavado en buffer collidina, deshidratado con acetona
de concentraciones crecientes y refijado en tetróxido de osmio. Luego fueron
pre-incluídos en partes iguales de acetona y plástico Araldita (Lab. Polysciences)
y posteriormente incluídos en Araldita, polimerizando a las 48 hs. Las secciones
de estos materiales fueron obtenidas con un Ultramicrótomo Porter Blum MT1 y
su espesor fue de aproximadamente 0,5 a 1 micra. Las mismas fueron coloreadas
con fucsina básica, azul de toluidina y la mezcla de ambos colorantes.
RESULTADOS
Los pacientes involucrados fueron de ambos sexos y su rango de edad osciló
entre los 17 y 68 años. Con respecto a la actividad laboral, 7 de ellos realizaban
tareas relacionadas con la construcción, fundamentalmente albañilería, 4 pacientes
en tareas domésticas, 1 paciente relacionado con maderas y productos químicos
utilizados en su manufacturación, 1 guardia de seguridad que estaba en contacto
con materiales derivados de la construcción, y uno solo de ellos realizaba tareas
de tipo administrativo.
En los 14 pacientes, existía una sospecha clínica del antígeno involucrado
en el proceso inflamatorio. Los resultados mostraron concordancia con la clínica.
OBSERVACIONES CLINICAS
En ambos tipos de lesiones, Primarias y Secundarias, los síntomas predominantes
fueron el prurito y el dolor, los cuales aumentaban si se acompañaban de infección.
Aquellos pacientes que estaban en contacto con productos de albañilería, presentaron
lesiones múltiples en diferentes estadíos evolutivos en diversas regiones corporales,
principalmente en manos. (Fig. Nº 2)
En las lesiones primarias, la signo-sintomatología primordial fueron: máculas,
pápulas y/o vesículas. En ocasiones las máculas se tornaban coalescentes, lo
cual originaba placas de aspecto eritematoso con marcado edema. Inicialmente
se observó que las lesiones estaban confinadas al lugar del contacto y variaban
en extensión de acuerdo a la intensidad o grado de exposición al antígeno.
OBSERVACIONES HISTOPATOLOGICAS
Los materiales correspondientes a lesiones crónicas, mostraron grados variables
de hiperqueratosis y acantosis irregular. En aquellos donde se observaba una
reagudización de las mismas, fue relevante la aparición de vesículas localizadas
en la región malpighiana (Fig Nº3). La dermis
papilar subyacente presentó dilatación de las estructuras capilares y abundantes
células de estirpe mononuclear predominantemente perivascular.
En biopsias de lesión provocada por parches, la espongiosis intraepitelial
fue más marcada que las lesiones primarias, con formación de vesículas grandes,
las cuales presentaban múltiples tabicaciones. En dermis papilar, se observó
infiltrado inflamatorio a predominio mononuclear.
OBSERVACIONES POR MEDIO DE HRLM
A nivel de epidermis, se observó espongiosis de grado moderado, pero llamó
la atención la separación de los elementos epiteliales. Los desmosomas se presentaban
con una disposición alargada, lo cual aumentaba visiblemente la separación intercelular.
En la capa basal se observó una hiperactividad del epitelio con nucleólos prominentes.
Dentro del citoplasma de las células basales se observaron vacuolas de diferente
tamaño. En la capa espinosa, la espongiosis se tornaba confluente, existiendo
ruptura de los desmosomas.
Más superficialmente, en la capa espinosa, las vesículas se encontraban totalmente
formadas, limitadas por pequeños tabiques muy delgados, que correspondían a
membranas basales de queratinocitos adyacentes. En algunos de los materiales
se observó la presencia a nivel suprabasal de Células de Langerhans, y en otros,
migrando hacia la dermis subyacente. (Fig. Nº4)
A nivel dérmico, se observó un infiltrado a predominio linfocitario, el cual
se ubicaba a nivel perivascular. Las células endoteliales se presentaron tumefactas,
disminuyendo la luz del capilar. En la matriz extracelular, tanto las fibras
de colágeno como las elásticas, se distribuían en forma anárquica y/o arremolinadas.
Ocasionalmente se observó pérdida de la periodicidad en las fibras de colágeno.
OBSERVACIONES INMUNOHISTOQUÍMICAS
La Inmunomarcación con los diferentes anticuerpos permitió tipificar los distintos
componentes celulares que caracterizan estas lesiones. Las Cél. de Langerhans
se identificaron predominantemente con el anticuerpo anti CD1a en la zona suprabasal
(Fig. N° 5).
Pudo comprobarse que el infiltrado inflamatorio tanto en biopsias de lesiones
primarias y secundarias fue destacadamente de tipo T, ya que la celularidad
se inmunomarcó con CD3 (Figs. N° 6 y 7).
En lesiones evolucionadas pudimos encontrar escasas células infiltrando el
epitelio positivas para CD45RA (p220) (Fig.
N° 8). Los linfocitos T de memoria (CD45RO-p180 positivas) conformando bandas
en el corion y en ocasiones traspasando el epitelio, se mostraron en forma abundante
sobre todo en lesiones provocadas (Fig. 9
y 10). Asimismo, pudimos observar que los
linfocitos T que se encuentran infiltrando, son linfocitos T activados ya que
expresaron CD25 en su superficie (Fig. N° 11
y 12). Esta activación linfocitaria pudo
confirmarse con la expresión de la cadena a4 del VLA-4 (CD49d, b1 integrina),
en los elementos celulares próximos a las vesículas (Fig.
N° 13 y 14).
Por último, la expresión del antígeno Sialil Lewis fue positiva en escasas
células en el corion papilar (Fig. N° 15
y 16).
COMENTARIOS Y DISCUSION
La combinación de diferentes técnicas utilizadas para la observación de los
materiales obtenidos de pacientes con Eczema por Contacto, permitieron dilucidar
algunos de los eventos fisiopatogénicos de la enfermedad, aportando por lo tanto,
una mayor comprensión de esta entidad. Además la interacción entre la Patología
convencional, la Subcelular por medio de HRLM y el reconocimiento de las moléculas
intervinientes por medio de la Inmunocitoquímica, permitió un mayor acercamiento
entre diferentes disciplinas y definir futuras estrategias de estudio.
La histopatología no puede ir más allá de los aspectos estructurales que aparecen
en estas lesiones, por lo que no puede diferenciar entre los diferentes eczemas.
La HRLM, es una técnica que debido a la calidad de su fijación y la inclusión
en resinas plásticas que permiten realizar cortes de 0,5 a 1 micra, otorga una
significativa visualización de las estructuras a estudiar (15-16).
Permite con un microscopio óptico acceder a la observación de estructuras subcelulares,
tales como gránulos, microvellosidades, depósitos de inmunocomplejos, etc. Además,
ya que no necesita del microscopio electrónico -instrumento que no siempre está
al alcance del patólogo práctico- para ser observado, disminuye costos y tiempos.
Así se observó que existe una clara desorganización del anclaje celular y una
importante intervención del Sistema Inmune de Piel (1)
y de la respuesta inflamatoria por la identificación adecuada de los elementos
celulares. La tumefacción de las células endoteliales fue muy evidente así como
las características de las células infiltrantes.
La Inmunocitoquímica permitió no solo la tipificación de las mismas, sino también
nos ayudó a la comprensión de los mecanismos utilizados por las células para
el desencadenamiento y perpetuación de la enfermedad.
El Eczema por Contacto, a pesar de ser una entidad frecuente en la práctica
médica diaria, no posee aún una clara resolución de muchas de sus incógnitas.
Esto es debido no sólo a la gran cantidad de antígenos que están presentes en
el medio externo, sino también al gran número de moléculas intervinientes en
el proceso inflamatorio (12-13-14-15).
Además existen otros problemas en esta patología, tales como: el mal estado
psicofísico del paciente, y la medicación corticoidea que, a pesar de sus efectos
beneficiosos transitorios, no termina de resolver el problema (5-8-9).
Es por todo esto que el estudio sistemático e interdisciplinario, permitirá
en un futuro, reconocer y poder manejar y prevenir de una manera racional e
integradora esta enfermedad.
BIBLIOGRAFIA
- Abbas A., Lichman A., Pober J. Inmunología
Celular y Molecular. Mc Graw -Hill. Edit. Interamericana España.
1995, págs.127-129, 248-260, 290-308.
- Lever SW, Elder D, Elenitsas R, Jaworsky C, Johnson
B. Histopathology of the Skin. USA Lippincott. 1997, págs.
209-213.
- Cohen L, Sjopicki D, Harrist T, Clark W. Lever W,
Elder D, Elenitsas R, Jaworsky C, Johnson B. Noninfectious Vesiculobullous
and Vesiculopustular Diseases. Histopathology of the Skin. USA Lippincott.
1997, Chapter 9: 213.
- Murphy G. Patología Humana. Editorial
Interamericana-McGraw-Hill, México.1998, 22: 754-755.
- Frede S, Martín A, Dionisio de Cabalier M, Ortiz
S, Serra M, Hliba E, Serra H. Estudio clínico-patológico en dermatitis
por contacto. Arch Argent Dermatol. 1999, 49: 113-119.
- Cohen D, Brancaccio R. What is new in clinical
research in Contact Dermatitis. Dermatol Clin. 1997, 15: 137-148.
- Carr R, Scarpelli D, Greider M. Allergic contact
dermatitis. Light and electron microscopic study. Dermatologica.
1986, 137: 358-368.
- Grabbe S, Schwart T. Immunoregulatory mechanisms
involved in elicitation of allergic contact hypersensitivity. Immunol
Today.1998, 19: 37-43.
- Santamaría Babi L, Picker L, Pérez Soler M, Drzimalla
K, Flohr P, Blaser K. Circulatin allergen-reactive T cells from patients
with atopic dermatitis and allergic contact dermatitis express the skin
selective homing receptor, the cutaneous lymphocyte-associated antigen.
J Exp Med. 1995, 1935-1940.
- Litle M, Metcalfe R, Haycock J, Healy J. Gawkrodger
D, Mac Neil S: The participation of proliferative Keratinocytes in
the preimmune response to sensitizing agents. Br J Dermatol. 1998,
138: 45-56.
- Nickoloff B, Turks L. Immunological functions
of non-professional antigen presentig cells: new insinghs from studies of
T Cell interactions with keratinocytes Immunol Today. 1994,15: 464-469.
- Canonica G, Ciprandi G, Passalacqua G, Pesce G,
Scardamaglia A, Bagnasco M. Molecular events in allergic inflammation,
experimental models and possible modulation. Allergy. 1997,52: 25-30.
- Zierhut M, Bieber T, Brocker E, Forrester J, Foster
C, Streinlein J. Immunology of the skin and eye. Immunol Today.
1996, 17: 448-450.
- Springer T: Traffic signals for lymphocyte
recirculation an leukocyte emigration. Cel. 1994, 76: 301-314.
- Weber C, Springer T. Interaction of very
late antigen-4 with VCAM-1 supports transendothelial chemotaxis of monocytes
by facilitating lateral migration. J Immunol. 1998, 161: 6825-34.
- Hoffman E, Flores T. High resolution light
microscopy in renal pathology. Am J Clin Pathol. 1981, 76: 636-639.
- Hoffman E, Flores T, Rodríguez F, Coover J. High
resolution light microscopy: histotechnology of the future? J Histotechnol.
1992, 15: 57-65.
FIGURAS

Fig. N° 1: Espalda de paciente (albañil) con parches positivos
a cromo y cobalto -antígenos del cemento- y thiurán -vulcanizante del
caucho, presente en guantes-.
|
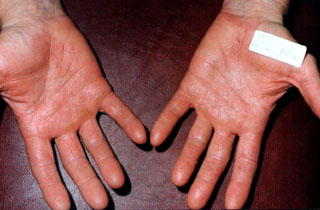
Fig. N° 2: Mano del mismo paciente que presenta lesiones
evolucionadas de la enfermedad, observándose vesículas.
|
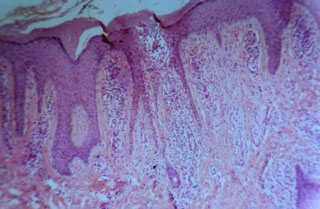
Fig. N° 3: En corte de biopsia de lesión provocada puede
observarse hiperqueratosis y papilomatosis irregular descendente. En
el centro, formación vesicular intraepidérmica. En dermis, infiltrado
inflamatorio de tipo mixto. Tinción H/E 100X.
|
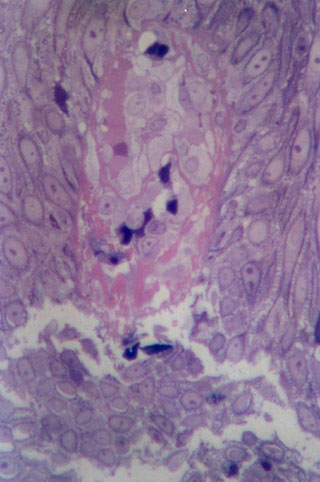
Fig. N° 4: Puede percibirse incremento del espacio intercelular
debido a las alteraciones que sufren los desmosomas. En sección de papila,
se observa célula de Langerhans. En el corion, vaso con endotelio hipertrófico
y células inflamatorias de tipo mononuclear. MOAR. Azul de toluidina
y fucsina básica. 400X
|
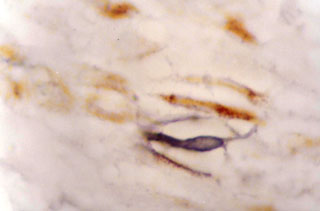
Fig. N° 5: Inmunomarcación con CD1, donde se observa Cél.
de Langerhans en ubicación suprabasal. DAB y verde de malaquita. 1000X.
|
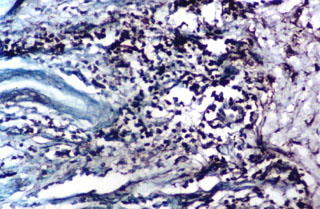
Fig. N° 6: Inmunomarcación con CD3 en biopsia de lesión primaria,
donde se observa marcado infiltrado linfocitario a predominio T. DAB
y verde de malaquita. 200X.
|
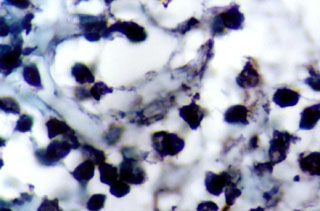
Fig. N° 7: Inmunomarcación con CD3 en biopsia de lesión primaria.
DAB y verde de malaquita. 1000X.
|
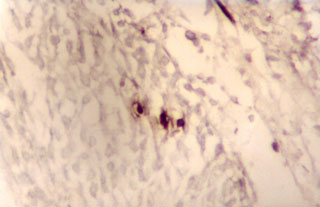
Fig. N° 8: Inmunomarcación con CD45RA demostrando migración
de leucocitos en la epidermis. DAB y verde de malaquita. 400X.
|
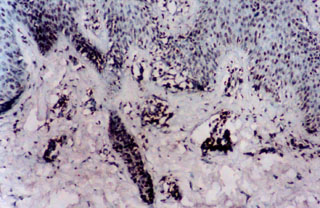
Fig. N° 9: Inmunomarcación con CD45RO en biopsia de lesión
primaria de paciente, demostrando abundante infiltrado linfocitario
T de memoria. DAB y verde de malaquita. 100X.
|
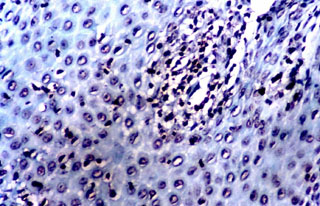
Fig. N° 10: Inmunomarcación con CD45RO en biopsia de parche
positivo a thiomersal, que muestra marcado infiltrado de células T de
memoria. DAB y verde de malaquita. 400X.
|
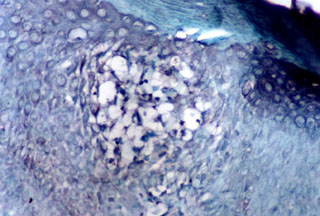
Fig. N° 11: Inmunomarcación con CD25 en biopsia de lesión
primaria, donde se observa en la zona de espongiosis células T activadas
infiltrando epidermis. DAB y verde de malaquita. 200X.
|
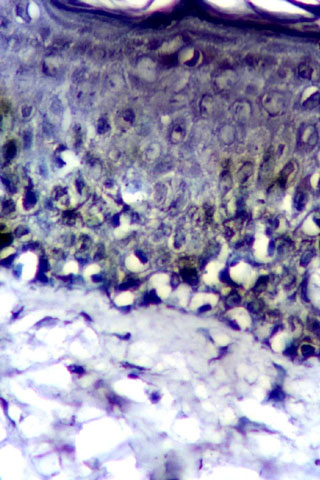
Fig. N° 12: Inmunomarcación con CD25 en biopsia de lesión
provocada con níquel, donde se observa células T activadas infiltrando
epidermis. DAB y verde de malaquita. 400X.
|
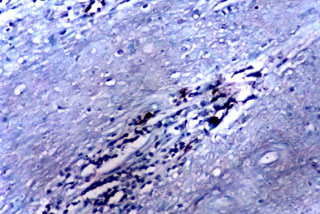
Fig. N° 13: Inmunomarcación con VLA4 (cadena a4) en biopsia
de lesión primaria, en donde se observan escasas células positivas en
papilas. DAB y verde de malaquita. 200X.
|
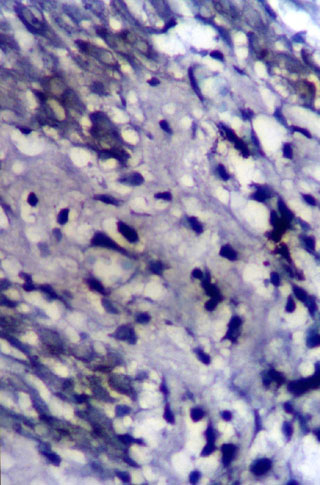
Fig. N°14: Inmunomarcación con VLA4 (cadena a4) en biopsia
de lesión provocada, que muestra abundantes células positivas en dermis
papilar. DAB y verde de malaquita. 400X.
|
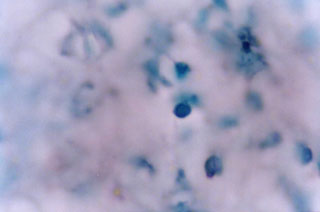
Fig. N°15: Inmunomarcación con CD15s en biopsia de lesión
primaria en paciente sensible al cromo, en donde se observan aisladas
células positivas. DAB y verde de malaquita. 1000X.
|
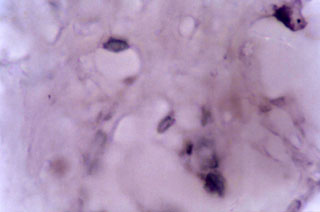
Fig. N°16: Inmunomarcación con CD15s en biopsia de lesión
provocada en paciente sensible al níquel, que muestra escasas células
positivas. DAB y verde de malaquita. 1000X.
|
AUTORES
Silvia Frede 1, Andrea Martín 2,
Susana Ortiz 3, María de Cabalier 4,
Ernesto Hliba 5, María Serra 6
y Horacio Serra 7.
- Dra. en Medicina y Cirugía. Docente de la Cátedra
de Patología Humana, Fac. de Cs. Químicas.
- Bioquímica. Becaria y Docente de la Cátedra de Inmunología,
Fac. de Cs. Químicas.
- Dra. en Medicina y Cirugía. Docente de la Cátedra
de Patología Humana, Fac. de Cs. Químicas, Profesora Adjunta de la II Cátedra
de Patología Fac. de Cs. Médicas.
- Dra. en Medicina y Cirugía. Profesora Adjunta de la
I Cátedra de Patología, Docente de la I Cátedra de Dermatología. Fac. de Cs.
Médicas.
- Dr. en Medicina y Cirugía. Profesor Titular de la Cátedra
de Patología Humana, Fac. de Cs. Químicas.
- Dra. en Medicina y Cirugía. Docente de la Cátedra de
Alergia e Inmunología, Fac. de Cs. Médicas.
- Dr. en Bioquímica. Profesor Adjunto de la Cátedra de
Inmunología, Fac. de Cs. Químicas.
Todos los integrantes pertenecen a la Universidad Nacional de Córdoba - Argentina.
Este trabajo fue parcialmente subsidiado por SECyT (Secretaría de Ciencia y
Técnica) de la Universidad Nacional de Córdoba.












